一半海水、一半火焰,分子表达操控中高频出现的Cre、Flp、Dre等重组酶系统如何工作
随着研究的不断深入,现代神经科学需要关注大量不同种类的神经元或胶质细胞,如多种GABA能中间神经元、小胶质细胞等。遗憾的是,这些细胞往往没有成熟的、不泄露的启动子供选择,那么在这种情况下,K8凯发·(中国)天生赢家·一触即发该如何实现细胞类型特异性的标记或操作呢?答案便是借助Cre-LoxP或Flp-FRT等重组酶系统。
简单来说,这类重组酶系统是通过特异位点重组酶(Site-specific recombinases, SSRs)介导重组酶特异识别位点(Recombination tar-get sites, RTs)间的重组,来实现特异位点的基因敲除、基因插入、基因翻转和基因易位等操作。由于该技术能够有效克服其他类型重组技术的非特异性或重组效率低等缺点,近年来已逐渐在功能基因研究领域占据了主导地位。
Cre-loxP的基本原理
Cre(Cyclization Recombination Enzyme)是一种重组酶,于1981年从P1噬菌体中被发现,其基因编码区序列全长1029bp,为38kDa大小的、由343个氨基酸组成的多肽单体蛋白。Cre重组酶的C-末端结构域包含催化活性位点,能够催化DNA分子中特定位点之间的重组。
LoxP是Locus of X-overP1的缩写,是位于P1噬菌体中长度为34bp的一段序列,由两个13bp的反向回文序列和8bp的中间间隔序列共同组成,反向回文序列是Cre重组酶的识别和结合区域,间隔序列决定LoxP序列的方向。
Cre重组酶不仅具有催化活性,而且与限制酶相似,能识别特异的DNA序列,即loxP位点,使两个loxP位点间发生基因重组。Cre重组酶无需借助任何辅助因子,可作用于多种结构的DNA底物,如线形、环状甚至超螺旋DNA。此外,Cre重组酶的活性可控,可以使之只在某类特定细胞类型中表达,也可以使之由特定的外部刺激(如化学信号、热刺激)触发表达。在神经科学领域,此技术可以用于对神经环路的特异性标记、特异细胞类型中内源基因的功能研究及构建小鼠模型等。
Cre-loxP诱导基因重组的几种方式
一般而言,当细胞基因组内存在两个LoxP位点时,Cre重组酶会诱导两个LoxP位点间的序列发生重组。首先,Cre重组酶结合到两个13bp的回文序列形成二聚体,然后这个二聚体和另外一个loxP位点上的二聚体结合,形成四聚体。LoxP位点是有方向的,形成四聚体的两个loxP位点是平行的,随后这两个loxP位点间的双链DNA被Cre重组酶切掉,然后切口在DNA连接酶的作用下重新连接。重组的结果取决于两个loxP位点的方向,主要有以下几种可能:
① 如果两个LoxP位点位于一条DNA链上,且方向相同,Cre重组酶能有效地删除两个LoxP位点间的序列(Deletion)(图1A);
② 如果两个LoxP位点位于一条DNA链上,但方向相反,Cre重组酶能诱导两个LoxP位点间的序列翻转(Inversion)(图1B);
③如果两个LoxP位点分别位于两条不同的DNA链或染色体上,Cre重组酶能诱导两条DNA链发生交换或染色体易位,即基因转座(Translocation)(图1C);
④如果四个loxP位点分别位于两条不同的DNA链或染色体上,Cre重组酶能诱导loxP间的序列互换(cassette exchange)(图1D)。
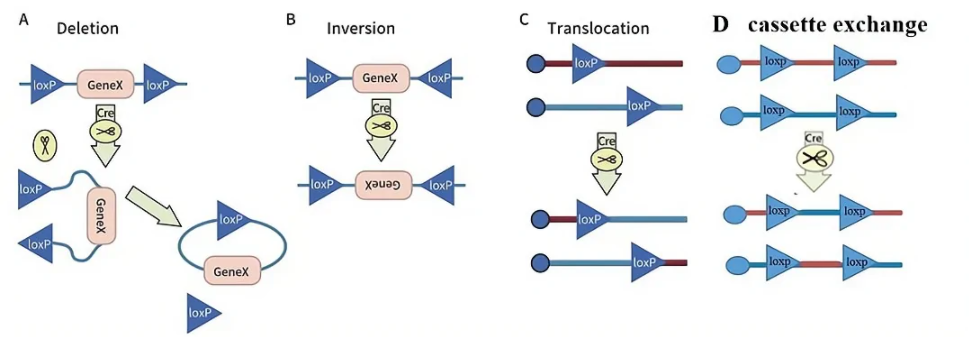
图1 Cre-loxP诱导基因重组的方式
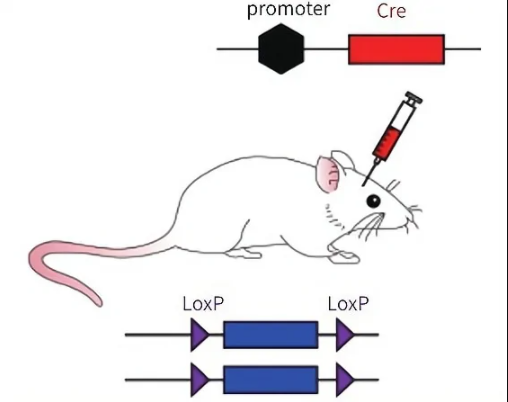
Cre-LoxP系统可以实现对基因的操控,根据Cre重组系统诱导基因重组的方式,K8凯发·(中国)天生赢家·一触即发可以通过如下两种策略实现Cre依赖的基因表达:
01 LSL序列(条件性基因选择)
将LoxP2和转录终止信号盒(Transcription STOP cassette)插入启动子和目的基因之间,转录终止信号盒两端各有一个同向的LoxP位点,组成LoxP-STOP-LoxP-gene模式,即LSL序列。
此情况下,在无Cre酶存在的细胞中,转录终止信号盒下游靶基因完全不表达,但如果细胞中含有Cre酶,基因重组中的Deletion过程发生,移除转录终止信号盒,进而表达目的基因。这是一种简单有效的办法,K8凯发·(中国)天生赢家·一触即发可以通过LSL的设置,有选择性地(根据Cre品系动物选择)在某些细胞中表达基因。但此法的缺点是可能会发生转录的泄露,即转录时跳过STOP序列,在无Cre酶的作用下也会表达基因。
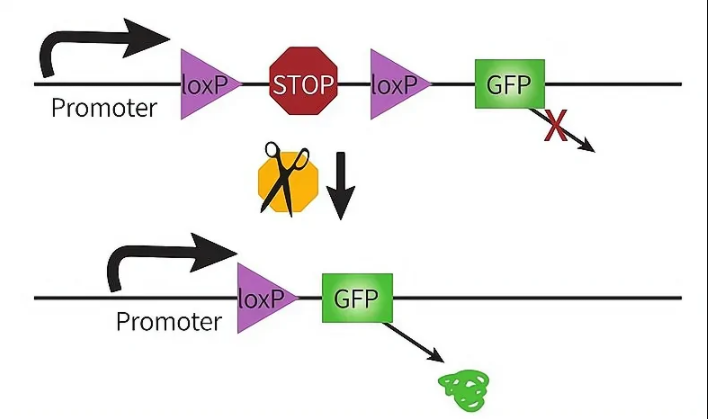
图2 Cre依赖的基因表达-LSL策略
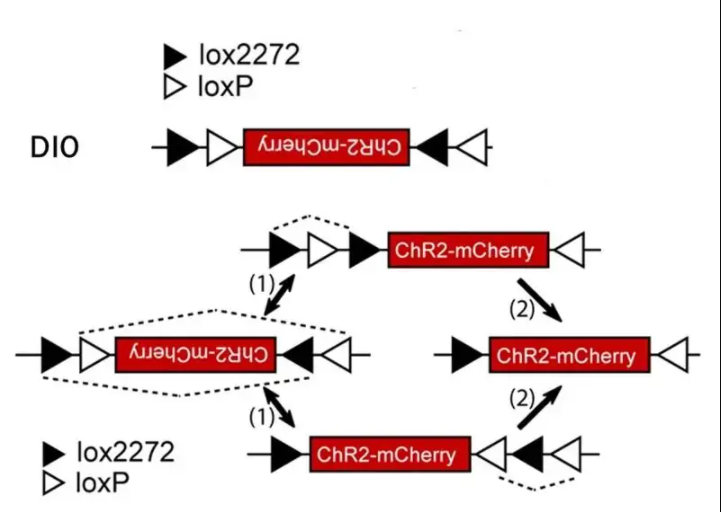
02 DIO/DO序列
通过引入两对不相容的反向Lox位点-LoxP和Lox2272,经过两组Lox位点的两轮重组可达到一种稳定状态。也就是可以通过Cre重组酶的存在与否来控制基因的表达。
这种策略被称为DIO(Cre-on)或DO(Cre-off)。在这种策略下,任一对Lox位点间的序列会在Cre的作用下发生可逆的快速翻转,之后Cre重组酶马上不可逆地切割翻转后的同向Lox位点,只留下翻转后的基因和单独的LoxP、Lox2272位点,防止基因的再次翻转。这种巧妙的设计让科研人员可以在病毒载体中构建DIO和反向基因,感染Cre阳性细胞后,可以让Cre阳性的细胞表达基因,是为DIO结构;如果预先包装的基因是正向,那么Cre阳性的细胞则不表达基因,其余细胞表达基因,是为DO结构。因此,人为操控基因表达变成了现实。
图3 借助LoxP和Lox2272的FLEX策略实现Cre依赖的基因表达(Scott M. Sternson, et al., J. Neurosci., 2008)
Cre-loxp系统的应用
1、特异性标记/环路示踪
可以借助Cre品系的小鼠和Cre依赖表达的病毒载体结合使用,达到特异性对某些细胞的标记和操控目的。运用神经示踪技术对大脑特定神经环路的结构和功能进行解析时,亦可以借助Cre重组酶系统和AAV血清型(比如rAAV2/9、rAAV2/retro、rAAV2/1)结合适用,达到特异性对神经环路标记和功能研究的目的。
2、病毒依赖的基因重组
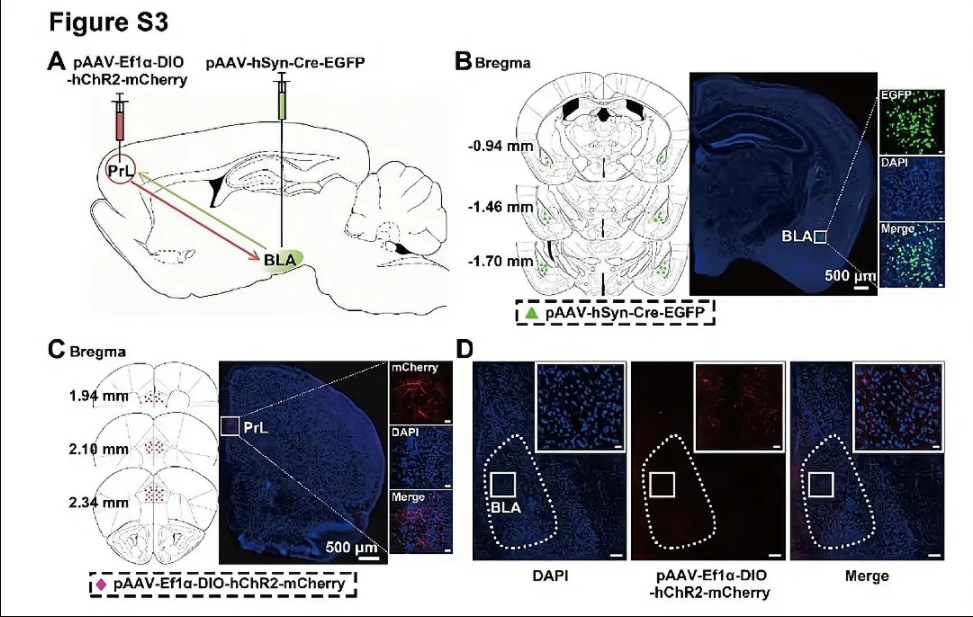
由于转基因动物依赖的基因重组存在耗时长、成本高、区域或者组织特异性不高等不足,现在越来越多的科研工作者开始采用比较灵活的方式使用Cre-loxP系统。通过病毒引入Cre或loxP元件,结合一种转基因小鼠是比较常用的方式(图5)。相比于转基因动物依赖的基因重组,病毒依赖的基因重组有以下优点:
更强的区域特异性:由于病毒可以通过局部注射的方式保证区域特异性感染,再加上驱动Cre基因的特异性启动子,能够实现更强的区域和细胞特异性的基因重组;
更少的花费:采购转基因动物的费用一般是比较昂贵的,而且转基因动物的饲养、基因型鉴定都需要不少的人力、物力,而病毒的制备、保存和注射所花的费用相对来说是比较少的;
更短的实验周期:由于病毒能非常迅速的起作用,而转基因小鼠的交配过程特别耗时间,因此采用注射病毒到转基因小鼠体内的方式,可以大量缩短实验周期。
图5 LoxP动物结合表达Cre的病毒进行基因敲除
Cre-loxP系统的优势
在当今世界上,Cre-loxP系统是在神经系统中应用广泛的条件性基因敲除工具,主要是因为该系统有如下优点:
高效性:Cre重组酶与具有loxP位点的DNA片段形成复合物之后,可以给足够的能力引发之后的DNA重组过程,重组过程简约高效;
特异性强:loxP位点是一段含回文序列结构和中间有间隔的34bp元件,这种结构保证了loxP序列的专一性,从而保证基因重组的特异性很强;
可应用范围广:Cre重组酶是一种比较稳定的蛋白质,可以在生物体不同的组织、不同的生理条件下发挥作用,所以说Cre-loxP系统的可应用范围非常广;
可由二型启动子启动表达:Cre重组酶的编码基因可由任何一种二型启动子驱动,由此保证Cre重组酶在生物体不同的细胞、组织、器官或者在不同的发育阶段或不同的胜利条件下表达,从而实现较高的组织和细胞特异性。
改造的Cre-loxP系统
经过现代基因工程方法对Cre和loxP元件的改造,Cre-loxP系统实现了更加丰富的条件性重组策略。
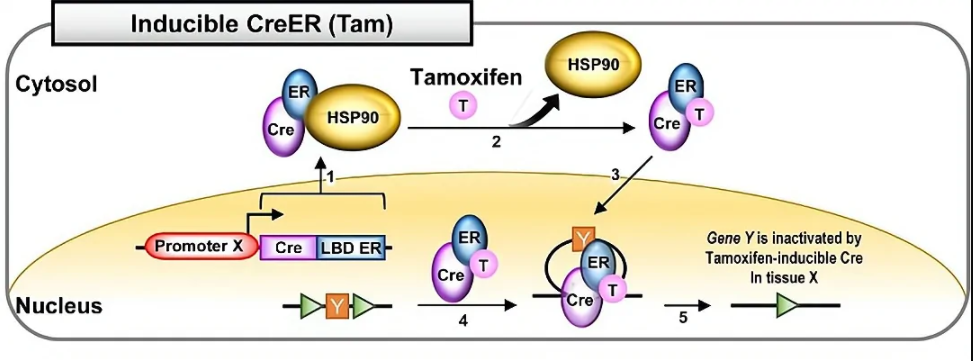
1、对Cre元件的改造:对Cre元件的改造提高了Cre重组酶的活性,并且实现了药物可诱导性。例如,通过在Cre元件上引入真核细胞核定位序列NLS,Cre重组酶能在低表达丰度下实现重组,这对于一些低丰度的启动子很重要。另外,在Cre元件的C端接上一段改造过的配体结合结构域LBD,新的融合蛋白Cre-LBD将定位在胞浆内,当人工合成的激素分子结合到Cre-LBD受体后,蛋白构象改变并进入核内,介导基因重组,目前使用较多的是tamoxifen诱导的CreERT2突变体,它的LBD来自于雌激素受体ER分子,当有tamoxifen的时候,Cre才能介导基因重组,这样通过控制tamoxifen的注射时间,可以实现对基因重组时间特异性的调控。
图6 tamoxifen诱导的Cre-ER系统(Hyeonhui Kim, et al., Lab Anim Res., 2018)
2、对loxP元件的改造:loxP元件也有一些突变体,间隔区和回文序列都可以进行突变,突变后的序列依然能被Cre重组酶识别和重组,但是突变的loxP序列必须和同样突变的loxP序列匹配介导基因重组,而不能和未突变的loxP序列匹配,这样将不同的loxP序列组合用于控制多个基因(如上文所述的lox2272位点),在同一Cre重组酶的作用下,可以实现多序列的基因重组,产生非常多元的重组结果。例如彩虹脑(Brainbow)技术绚丽多彩的荧光标记效果正式基于对loxP序列的改造实现。
其他重组酶系统
除Cre-LoxP系统外,类似的还有与Cre-LoxP系统无交叉影响的vCre-vLoxP、sCre-sLoxP系统,及Flp-FRT/F5系统和Dre-Rox1/Rox2系统,对应的表达方案分别为fDIO和dDIO系统。多套重组酶体系的存在为研究中设计多个限制条件给了便利,灵活应用Cre、Flp、Dre重组酶系统将有助于更深入课题的开展(图7)。
Flp-FRT系统
Flp-FRT系统与Cre-loxP类似,也是由一个重组酶和一段特殊的DNA序列组成。其中,Flp(flippase recombination enzyme)重组酶,是从酵母细胞内被发现的,其基因全长1272bp,为48kDa大小的、由423个氨基酸组成的多肽单体蛋白。
FRT是Flp的识别位点,全长48bp,由3个13bp的反向回文序列和8bp的间隔序列共同组成(图7a)。与间隔序列相邻的两个反向回文序列是Flp重组酶的识别和结合区域,间隔序列是重组发生的区域,也决定了整个序列的方向。
Flp-FRT系统与Cre-loxP诱导基因重组的方式类似,这两个系统比较明显的区别是这个重组酶(Cre和Flp)具有不同的较佳反应温度,有研究发现,Cre重组酶的较佳温度为37℃,而Flp重组酶为30℃。后来科学家们,构建了Flp突变体--Flpo,其在37℃也表现出较好的耐热性。
Dre-Rox系统
Dre(D6 site-specific DNA recombinase)也是从噬菌体中发现的一种酪氨酸重组酶,其识别的是32bp的DNA序列rox,包含两个14bp反向回文序列和4bp的中间间隔序列(图7a)。Dre重组酶和Cre重组酶具有特异性,Dre重组酶不能识别loxp位点,同时Cre重组酶也不能识别rox位点。
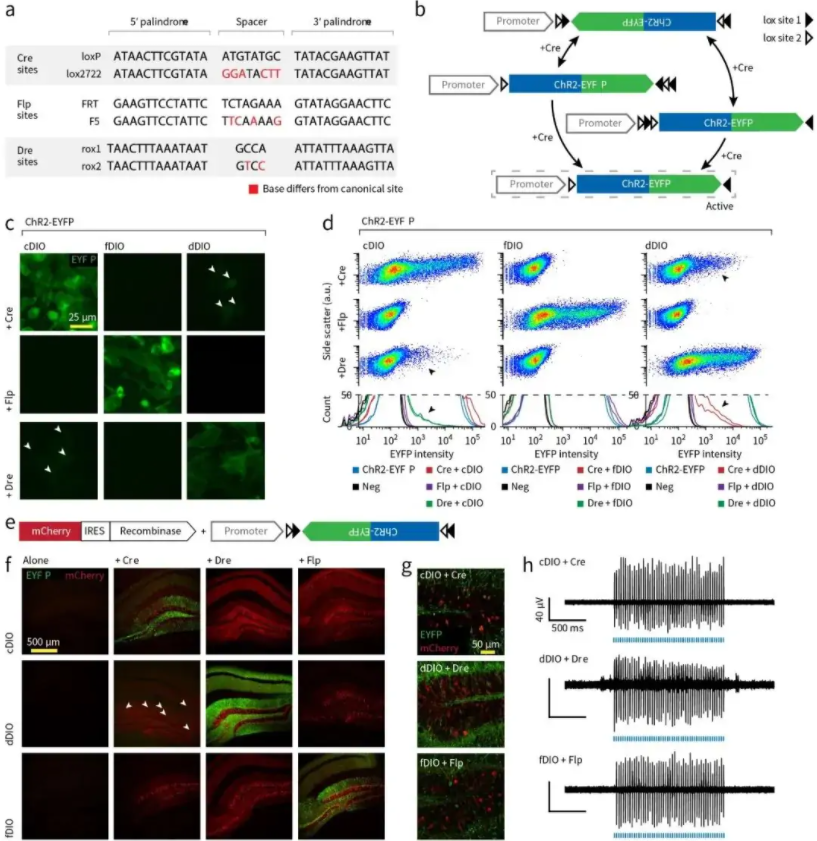
图7 Cre\Flp\Dre系统比较(Lief E Fenno, et al., Nat Methods., 2014)
vCre-vloxp和sCre-sloxp系统
vCre和sCre均为Cre重组酶的同源蛋白,但他们与Cre的同源性很低,可以特异性识别vloxp和sloxp位点。
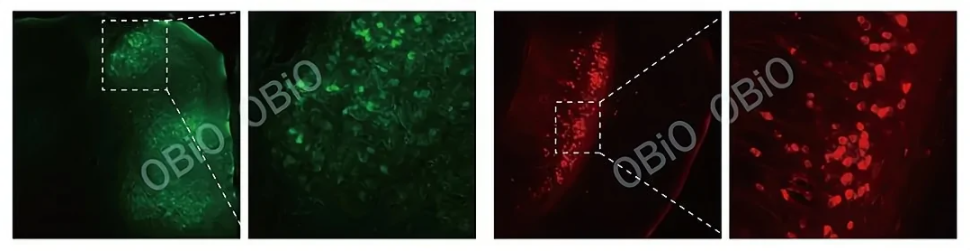
图8 借助vCre-vloxp系统标记mPFC-vHPC的投射
参考文献
[1] Front Genet. 2016 Feb 19;7:19. doi: 10.33/fgene.2016.00019.
[2] Sci Adv. 2019 Feb 20;5(2):eaat3210. doi: 10.1126/sciadv.aat3210.
[3] Nat Methods. 2014 Jul;11(7):763-72. doi: 10.1038/nmeth.2996.
[4] J Biol Chem. 2020 Jan 17;295(3):690-700. doi: 10.1074/jbc.RA119.011349.
[5] J Neurosci. 2008 Jul 9; 28(28): 7025–7030.doi: 10.1523/JNEUROSCI.1954-08.2008
[6] Lab Anim Res. 2018 Dec;34(4):147-159. doi: 10.5625/lar.2018.34.4.147.
[7] Nucleic Acids Res. 2004 Nov 18;32(20):6086-95. doi: 10.1093/nar/gkh941.
[8] Dis Model Mech. Sep-Oct 2009;2(9-10):508-15. doi: 10.1242/dmm.003087.
[9] Nucleic Acids Res. 2011 Apr;39(8):e49. doi: 10.1093/nar/gkq1280.